В 2025 году журналу
ИСПОЛНИТСЯ
95 ЛЕТ!
ЧИТАЙТЕ
Материалы к юбилею >>>

РУБРИКИ
 Племенное дело |
 Крупный план |
 Актуально |
 Корма |
 Техническая политика |
 Событие |
 Ветеринария |
 Эксклюзивное интервью |
 Статистика |
 Выставки |
Творчество
наших читателей
ЧИТАЙТЕ
Автор С.И. КАЛИНИЧЕНКО
ГИМН СВИНЬЕ >>>
СТАТЬИ ИЗ НОМЕРА
DOI: 10.37925/0039-713X-2024-6-25-30
УДК 575.222:57.083.34
ИММУНОФЛУОРЕСЦЕНТНАЯ РЕАКЦИЯ АГГЛЮТИНАЦИИ ДЛЯ ДИАГНОСТИКИ АССОЦИИРОВАННЫХ ИНФЕКЦИЙ СВИНЕЙ
Ю.С. ХОМЕНКО3, мл. научный сотрудник, e-mail: ariskina91@mail.ru, Е.Ю. ДЕРЕВЯГИНА1,2, лаборант-микробиолог, e-mail: atjamishina347@mail.ru, А.В. АФОНЮШКИН1,2, студент, e-mail: artemka3451@gmail.com, В.Н. АФОНЮШКИН1,3,4, кандидат биолог. наук, зав. сектором, e-mail: lisocim@mail.ru, К.Е. ИЛЬИНА5, исполнительный директор, e-mail: kseniya.surodina@alekris.ru, 1ФГБОУ «Новосибирский государственный аграрный университет», 2ООО «Сибтехновет», 3ФГБУН «Сибирский федеральный научный центр агробиотехнологий РАН» (п. Краснообск), 4Институт химической биологии и фундаментальной медицины СО РАН (Новосибирск), 5ООО «Алекрис-консалтинг»
В статье представлена разработка диагностического алгоритма выявления ассоциированных вирусно-бактериальных инфекций свиней.
Исследования проводили в стаде, характеризующемся наличием множественных абсцессов, ламинитов, дерматитов и респираторной патологии у свиней. Для выявления ассоциированных инфекций РРСС с бактериями, выделенными от больных животных, использовали иммунофлуоресцентную реакцию агглютинации (ИРА) с флуоресцентно-меченым антигеном. Антитела к РРСС определяли методом ИФА с применением набора реагентов «РРСС-СЕРОТЕСТ».
В ходе исследований было выявлено присутствие в стаде антител к вирусу РРСС. У обследованного поголовья наблюдались ассоциированные инфекции Streptococcus suis, Escherichia coli, Trueperella pyogenes, которые не зависели от РРСС. Предложенный алгоритм серологической диагностики основан на выделении культур бактерий у больных животных, проведении с антигенами из этих бактерий агглютинационных тестов, сопоставлении уровней и наличия антител к различным вирусным и бактериальным агентам.
Данный методический подход позволил установить взаимосвязь между Trueperella pyogenes, Streptococcus suis и E.coli и исключить вклад в эту ассоциированную инфекцию РРСС. Универсальность предложенной методологии перспективна для диагностики широкого спектра бактериальных и вирусных ассоциированных и моноинфекций.
Ключевые слова: ИРА, ИФА, свиньи, РРСС, Trueperella pyogenes, Streptococcus suis, Escherichia coli.
Immunofluorescence agglutination test for diagnostics of associated infections in pigs
Yu.S. KHOMENKO3, junior researcher, e-mail: ariskina91@mail.ru, E.Yu. DEREVYAGINA1,2, laboratory assistant-microbiologist, e-mail: katjamishina347@mail.ru, A.V. AFONYUSHKIN1,2, student, e-mail: artemka3451@gmail.com, V.N. AFONYUSHKIN1,3,4, candidate of biological sciences, head of group, e-mail: lisocim@mail.ru, K.E. ILYINA5, executive director, e-mail: kseniya.surodina@alekris.ru, 1Novosibirsk State Agrarian University, 2Sibtekhnovet LLC (Novosibirsk), 3Siberian Federal Center of Agrobiotechnologies RAS (Krasnoobsk), 4Institute of Chemical Biology and Fundamental Medicine SB RAS (Novosibirsk), 5Alekris-Consulting LLC
The purpose of the research was to develop a diagnostic algorithm for identifying associated viral-bacterial infections in pigs.
The studies were carried out on a farm characterized by the presence of multiple abscesses, laminitis, dermatitis and respiratory pathology in pigs. To detect associated PRRSV infections with bacteria isolated from sick animals, an immunofluorescent agglutination reaction with a fluorescently labeled antigen was used. Antibodies to PRRS were determined by ELISA using the PRRS-SEROTEST reagent kit.
The research revealed the presence of antibodies to the PRRS virus in the herd. The examined livestock had an associated infection with Streptococcus suis, Escherichia coli, Trueperella pyogenes, which were not dependent on PRRS. The proposed serological diagnostic algorithm based on: isolating bacterial cultures from sick animals, conducting agglutination tests with antigens from these bacteria, comparing the levels and presence of antibodies to various viral and bacterial agents.
This methodological approach allowed us to establish the relationship between Trueperella pyogenes, Streptococcus suis and E.coli and exclude the contribution of PRRSV to this associated infection. The versatility of the proposed methodology is promising for diagnosing a wide range of bacterial and viral associated and mono infections.
Key words: IRА, ELISA, pigs, PRRS, Trueperella pyogenes, Streptococcus suis, Escherichia coli.
Введение
Бактериальные инфекции представляют актуальную проблему для здравоохранения, санитарно-эпидемиологического и ветеринарного надзора в большинстве стран мира. Это связано с высоким уровнем заболеваемости и отсутствием предпосылок к его сокращению, обусловленных появлением устойчивых к антибиотикам штаммов. В то же время большинство случаев массовых бактериальных инфекций являются вторичными и вызваны вирусными инфекциями или иными факторами, повышающими проницаемость слизистых барьеров, снижающих иммунитет и т.д.
Вирус РРСС относится к порядку Nidovirales семейству Arteriviridae роду Arterivirus [3]. Данный вирус заражает макрофаги, являющиеся общими членами системы мононуклеарных фагоцитов, которые играют разнообразную и важную роль во многих аспектах ремоделирования тканей, иммунитета и иммунопатологии [2, 4, 11]. Вирус РРСС передается алиментарным, контактным и половым путем [20]. Более всего ему подвержен молодняк. У взрослого поголовья болезнь протекает в хронической форме практически без симптомов [12]. При хроническом вирусоносительстве у хряков-производителей развивается бесплодие, а у свиноматок увеличивается число прохолостов.
Генетическая изменчивость вируса не дает возможности для развития полноценного защитного иммунного ответа при использовании гетерологичных вакцин. При инфицировании свиней вирусом РРСС у них формируется гуморальная реакция с образованием специфических иммуноглобулинов и выработкой клеточного иммунного ответа. Колостральный иммунитет длится до 70-дневного возраста и не может полностью предохранить поросят от инфицирования вирусом РРСС. Иммунитет, полученный после заболевания или вакцинации поголовья, непродолжителен [12].
В контексте наших исследований наличие такого наиболее массового заболевания позволило выдвинуть гипотезу о первичной роли РРСС в развитии комплекса вторичных бактериальных инфекций.
Trueperella pyogenes относится к семейству Actinomycetaceae и представляет собой грамположительные, β-гемолитические, неподвижные, не кислотоустойчивые, не образующие капсулу и споры микроаэрофильные короткие палочки. Эта бактерия растет на средах, богатых кровью и (или) сывороткой, которую часто используют для культивирования [16, 17]. T.pyogenes обнаруживается в мочеполовой системе, желудочно-кишечном тракте и верхних дыхательных путях крупного рогатого скота, коз, лошадей, кабарги, свиней и овец, у которых он может вызывать абсцессы, мастит, метрит и пневмонию [6, 8, 9, 13–17].
Передача инфекции от животного к животному может происходить через контаминированную посуду [8], природную среду [13] или укусы мух (Hydrotaea irritans) [17]. У людей T.pyogenes не является частью нормальной флоры человека, и инфекции часто связаны с контактом с животными [17].
Типичным клиническим признаком инфекции, вызванной T.pyogenes, является наличие у животных абсцессов в подкожной клетчатке, органах или мышцах, которые обнаруживаются преимущественно только посмертно. Их размер изменяется и колеблется от нескольких миллиметров до нескольких сантиметров в диаметре. Они окружены жесткой толстой волокнистой капсулой из соединительной ткани с зеленовато-желтым гноем внутри, который имеет жидкую или гранулированную консистенцию. Абсцессы могут быть локализованы в различных частях тела, а следствием их формирования является развитие гнойных воспалений костей, костного мозга, суставов, легких, сердечной мышцы, матки, почек, печени, молочной железы и т.д. [9, 16, 17].
Escherichia coli является бактерией, встречающейся в пище, кормах, кишечнике людей и животных. В то время как многие штаммы являются безопасными, некоторые штаммы E.coli патогенные, вызывают тяжелые заболевания и диарею, они также могут провоцировать заболевания вне пищеварительного тракта. Например, энтеротоксигенная E.coli (ETEC), которая провоцирует диарею, дегидратацию, истощение и смерть. Она является основной причиной заболеваний новорожденных и только отлученных от свиноматки поросят и передается через загрязненную воду и пищу или посредством контакта с животными или людьми. Это может оказывать огромное влияние на продуктивность свиней – до 25% падежа поросят, уменьшение темпов прироста, а также на увеличение расходов на ветпрепараты [2, 20, 21].
Streptococcus suis – микробный патоген, вызывающий заболевания у домашних свиней и человека в виде менингитов, септицемий, пневмоний, артритов и наносящий значительный экономический ущерб отрасли свиноводства во всем мире [10, 19].
Для повышения эффективности и универсальности серологических обследований свиней, неблагополучных по Trueperella pyogenes, Escherichia coli, Streptococcus suis, была предложена система на основе реакции агглютинации с флуоресцентно-меченым антигеном. Реакция проходит в лунках 96-луночного микропланшета с V-образным дном [1, 5].
Цель исследования – определить ассоциацию РРСС с бактериальными инфекциями свиней, вызванными Trueperella pyogenes, Escherichia coli, Streptococcus suis.
Материалы и методы
Исследования проводили на базе сектора молекулярной биологии Сибирского федерального научного центра агробиотехнологий РАН. Материал отбирали в фермерском хозяйстве Алтайского края, характеризующемся массовой заболеваемостью свиней и поросят.
Материалом для микробиологического исследования служили головной и костный мозг, кровь сердца, селезенка, печень, суставная жидкость вынужденно забитых животных и кровь больных и переболевших свиней. Для серологических исследований изучали 15 проб крови поросят в возрасте от одного до пяти месяцев. Мазки-отпечатки с патологического материала окрашивали по Леффлеру и микроскопировали. Материал для гистологических исследований фиксировали в 10%-ном формалине. После парафиновой гистологической проводки по Меркулову делали гистологические срезы, депарафинировали в ксилоле и окрашивали гематоксилином Эрлиха и эозином.
Посевы производили на кровяной агар, сердечно-мозговой бульон (гемокультуры) и эугоник агар с 0,01% амидо черного 10Б.
Видовую принадлежность культур выделенных микроорганизмов подтверждали методом секвенирования гена 16S рибосомальной РНК. ДНК бактерий выделяли стандартным силико-сорбционным методом.
Серопревалентность к антигенам Trueperella pyogenes, Escherichia coli, Streptococcus suis оценивали в сыворотке крови свиней в возрасте от двух до семи месяцев. Антитела к РРСС определяли методом ИФА с использованием набора реагентов «РРСС-СЕРОТЕСТ».
Иммунофлуоресцентную реакцию агглютинации проводили по следующему протоколу: антигены получали из предварительно убитой нагреванием до 65оС в течение трех часов взвеси бактериальных клеток (суточные культуры ресуспендировали в физиологическом растворе до 2 MFU) [5, 20]. Использовали инактивированные культуры выделенных из патологического материала микроорганизмов. Для извлечения флуоресцентно-меченых антигенов к взвеси инактивированных бактериальных клеток добавляли 0,1%-ный раствор флуоресцентного красителя – акридиновый оранжевый, после инкубации в течение часа не связавшийся краситель трехкратно отмывали центрифугированием (3000 об./мин.).
Предварительно определили оптимальную концентрацию антигенов. Для этой цели антигены разводили в пропорции 1:2 и вносили в лунки 96-луночного микропланшета с V-образным дном через 16 часов инкубации. Далее проводили реакцию агглютинации с сыворотками крови, которые раститровали с шагом 1:2, вносили антигены и после инкубации в течение 16 часов оценивали светимость антигенов по типу «пуговка» или «зонтик» с помощью трансиллюминатора GelDoс Bio-Rad. Обработку изображений осуществляли с использованием ПО Image Lab (Bio-Rad).
Статистическую обработку данных производили методами вариационной и непараметрической статистики, нормальность распределения оценивали по методу Шапиро-Уилка, коэффициент корреляции анализировали по Пирсону и Спирмену, статистическую значимость различий – по Манну-Уитни.
Результаты исследований
Наблюдалось массовое заболевание поросят и свиноматок разного возраста. Встречались множественные абсцессы, преимущественно в области межкопытной щели, ламиниты, дерматиты (фото). Этот комплекс поражений кожи сопровождался в основном респираторной патологией (кашель). При убое фиксировали пневмонии.
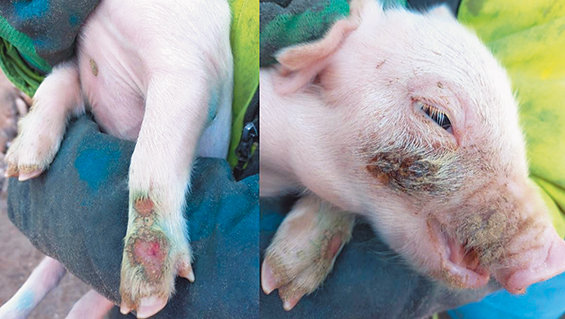
Фото. Гнойно-некротические поражения кожи поросят
В мазках-отпечатках из легких и почек при диагностическом убое больных поросят наблюдали стрептококки (рис. 1).
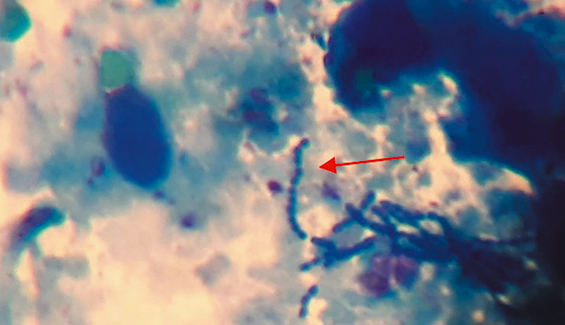
Рис. 1. Стрептококки в мазках-отпечатках почек
При гистологическом исследовании срезов ткани легкого наблюдали тромбоз легочных сосудов, наличие сегментоядерных нейтрофилов указывает на пневмонию (рис. 2).
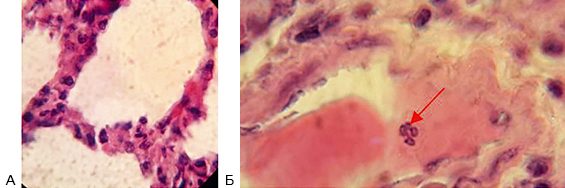
Рис. 2. Легкое свиньи (окраска гематоксилином и эозином)
А – альвеола, Б – сегментоядерный нейтрофил на месте образования внутрисосудистого тромба
Так как при микробиологических исследованиях и микроскопическом анализе у больных животных обнаруживали несколько микроорганизмов, то была предпринята попытка изучить взаимосвязь выделенных бактерий в развитии инфекционного процесса. Из выделенных культур были приготовлены антигены для ИРА и оценены уровни антител, серопревалентность (рис. 3).

Рис. 3. Оценка уровня антител к бактериальным антигенам с помощью ИРА
А – E.coli, Б – T.pyogenes
Уровни антител к E.coli, T.pyogenes и S.suis различаются в зависимости от серологического статуса к РРСС, но они статистически незначимы (рис. 4). Поросята с положительным серологическим статусом к РРСС имеют более высокие уровни антител к E.coli, T.pyogenes и S.suis, чем поросята с отрицательным серологическим статусом. Это может указывать на индивидуальные особенности гуморального иммунитета у отдельных особей, но не на взаимосвязь бактериальных инфекций с РРСС у всего поголовья в целом.
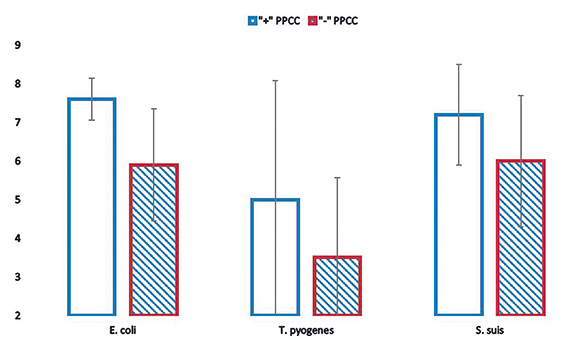
Рис. 4. Титры антител к антигенам S.suis, T.pyogenes, E.coli у поросят с разным серологическим статусом к РРСС (log2 (М+SD)
Результаты четырехпольной таблицы сопряженности показывают, что отсутствует связь между серологическим статусом T.pyogenes и результатами на РРСС (табл. 1).
Таблица 1. Четырехпольная таблица сопряженности серологического статуса
|
Возбудитель |
Результат на РРСС |
Всего |
|
|
+ |
- |
||
|
T.pyogenes + |
4 |
6 |
10 |
|
T.pyogenes - |
1 |
4 |
5 |
|
χ2 |
0,6 (P-value = 0,439) |
||
Коэффициенты корреляции между уровнями антител показывают, что существует связь между уровнями антител к E.coli, T.pyogenes иУровень антител к E.coli имеет наибольшую связь с уровнем антител к.suis (табл. 2).
Таблица 2. Коэффициенты корреляции между титрами антител (r2)
|
Возбудитель |
E.coli |
T.pyogenes |
S.suis |
|
E.coli |
0,620 |
0,843 |
|
|
T.pyogenes |
0,783 |
||
|
S.suis |
Обсуждение
В данном исследовании была проведена оценка эффективности использования иммунофлуоресцентной реакции агглютинации для диагностики ассоциированных инфекций РРСС с Trueperella pyogenes, Streptococcus suis и E.coli у свиней.
В ходе исследования было обнаружено, что у поросят, больных РРСС и стрептококкозом, наблюдается значительное повышение уровня антител к На первый взгляд, это свидетельствует о наличии коморбидности между этими заболеваниями, то есть они часто протекают у свиней одновременно. Однако следует учесть и тот момент, что многие ИФА-системы содержат рекомбинантные антигены вирусов, наработанные в системе E.coli, поэтому риски перекрестных реакций у животных, переболевших эшерихиозом, в наши дни существенно выросли. Дальнейшие исследования переболевших животных позволили исключить наличие сероконверсии к вирусу РРСС.
У обследованного поголовья наблюдается ассоциированная инфекция S.suis, E.coli и Trueperella pyogenes, то есть патологии, вызванные этими инфекционными агентами, развиваются вне зависимости от РРСС, но фиксируется корреляционная связь этого агента с S.suis и E.coli. Можно предположить, что без успешной профилактики коли-инфекции и стрептококкоза борьба с трупереллой не может быть эффективна. В дальнейшем применение аутогенной вакцины позволило сократить инцидентность как респираторной патологии, так и абсцессов кожи, ламинитов, что подтверждает вовлеченность выделенных штаммов бактерий в патологические процессы.
В данном исследовании применялись три основных статистических подхода, позволяющих выявить взаимосвязь (коморбидность) между инфекциями. Наиболее простым и близким подходом для практикующего врача является вычисление средних титров антител к тому или иному микроорганизму в зависимости от серологического статуса к вирусному агенту (в данном случае к РРСС). Однако без оценки статистической значимости различий возможна диагностическая ошибка. К сожалению, проверку на случайности выявленных взаимосвязей в ветеринарной практике редко кто проводит.
Другой подход используется при небольшой инфицированности и, соответственно, не 100%-ной серопревалентности (когда не все животные имеют титры антител). Такой качественный анализ в принципе удобен не только для выявления взаимосвязи между наличием болезни и антител к возможным возбудителям инфекции, но и применим для вычисления коморбидности. В данном примере исключена взаимосвязь между T.pyogenes и РРСС, так как показатель такой связи χ2 очень мал – всего 0,6 и статистически незначим (табл. 1).
В случае с инфекциями, характеризующимися большей долей серопозитивных животных (стрептококкозы и эшерихиозы), мы применили вычисление коэффициентов корреляции, отражающих взаимосвязи между уровнями антител. Все анализируемые бактерии приводили к образованию антител, коррелирующих друг с другом (табл. 2). Так как вероятность синхронной манифестации трех инфекций, вызванных довольно разными микроорганизмами, стремится к нулю, то следует рассуждать или о наличии общего фактора (вирусная инфекция, еще один микроорганизм, влияющий на иммунитет слизистых барьеров, микотоксикозы, погрешности в содержании), или о ведущей роли одного из микроорганизмов, воздействующих в том числе на вовлечение в инфекционный процесс других бактерий.
Анализ научной литературы показывает пересечение элементов патогенеза стрептококковой инфекции свиней и инфекции, вызванной T. Гемолизин PLO T.pyogenes и гемолизины стрептококков активируют воспалительные реакции иммунной системы, провоцирующие пироптоз (стимуляция образования IL-1b), сопровождающийся гибелью макрофагов. С другой стороны, стимуляция образования IL-10 выглядит довольно парадоксальной на фоне бактериальной инфекции, но, очевидно, способствующей подавлению активации адаптивного иммунитета по месту инфицирования [14].
Кишечная палочка также может вовлекаться в индукцию пироптоза, но по альтернативному пути (p53–p21) [21]. Возможно, что подавление макрофагального звена выгодно всем штаммам, которые способны противостоять реакциям иммунитета именно таким образом. Нарушение презентации антигенов, опосредованное сразу и разрушением макрофагов, и подавлением активности Т-хелперов IL-10, может провоцировать хронизацию инфекционного процесса как для стрептококков, так и для труперелл. Обилие кишечной палочки в организме, видимо, гарантирует ее вовлечение в качестве гнилостной микрофлоры при повреждении слизистых.
Наличие антител к РРСС в данном исследовании не показало взаимосвязи с бактериальными инфекциями и не исключает циркуляции вакцинного штамма или остаточных колостральных антител от ранее привитых инактивированной вакциной свиноматок.
Результаты исследования имеют практическое значение в качестве алгоритма диагностики и контроля заболевания свиней. Например, проведенные опыты позволили исключить необоснованную вакцинацию против РРСС, оценить взаимосвязь выделяемых у больных свиней культур бактерий с наблюдаемыми патологиями. Учитывая, что серологических тест-систем для выявления антител к T.pyogenes нет, разнообразие антигенной структуры кишечной палочки и стрептококков в принципе ограничивает возможности создания надежных ИФА-тестов. Предложенный алгоритм серологической диагностики бактериальных инфекций свиней выглядит перспективным, особенно в комплексе с традиционными ИФА-тестами на антитела к возбудителям вирусных инфекций.
Кроме того, результаты исследования могут быть использованы для разработки эффективных мер по предотвращению распространения инфекций среди свиней, включая применение аутогенных и традиционных вакцин, и пресечению путей заноса и циркуляции эпизоотически значимых патогенов на основании своевременного выявления неблагополучных родительских стад, репродукторов и т.д.
Заключение
Предложенный алгоритм серологической диагностики, основанный на выделении культур бактерий у больных животных, проведении с антигенами из этих бактерий агглютинационных тестов, сопоставлении уровней и наличия антител к различным вирусным и бактериальным агентам, позволил установить взаимосвязь между Trueperella pyogenes, Streptococcus suis и E.coli и исключить вклад в эту ассоциированную инфекцию РРСС. Универсальность данной методологии уместен для диагностики широкого спектра бактериальных и вирусных ассоциированных и моноинфекций.
Работа выполнена при поддержке Российского научного фонда (проект №24-26-00238)
Литература
- Афонюшкин В.Н., Филипенко М.Л., Киревичева А.С., Мишукова О.В., Черепушкина В.С., Ширшова А.Н. Способ определения антител к бактериальным антигенам. Патент RU 2 563 885 C1 27.09.2015. Бюллетень №27.
- Бригадиров Ю.Н. Комплексная система мероприятий по профилактике и борьбе с респираторными и желудочно-кишечными болезнями свиней в современных условиях производства/Ю.Н. Бригадиров, О.В. Казимиров, С.В. Борисенко, М.Л. Бердников, Е.В. Михайлов, А.Н. Модин, Н.А. Борисенко, О.А. Манжурина, В.В. Довыдова. Ветеринарная патология, 2011. №4. С. 40–44.
- Забережный А.Д. Современная таксономия вирусов/А.Д. Забережный, Л.В. Костина, А.Г. Южаков, И.А. Гулюкина, Т.В. Степанова, В.В. Стаффорд, И.В. Полякова, Е.И. Дроздова. Ветеринария и кормление, 2017. №1. С. 4–13.
- Орлянкин Б.Г. Диагностика и специфическая профилактика РРСС/Б.Г. Орлянкин, Е.А. Непоклонов, Т.И. Алипер, А.Д. Забережный, М.И. Мусиенко. Ветеринария сельскохозяйственных животных, 2006. №12. С. 14.
- Хоменко Ю.С., Козлова О.С., Афонюшкин А.В., Афонюшкин В.Н. Изучение эпизоотической значимости Salmonella enterica серотипа Hamburg на птицеводческих предприятиях с использованием серологических исследований. Птицеводство, 2022. №12. С. 92–95.
- Amos M.R., Healey G.D., Goldstone R.J., Mahan S.M., Düvel A., Schuberth H.-J. et al. Differential endometrial cell sensitivity to a cholesterol-dependent cytolysin links Trueperella pyogenes to uterine disease in cattle. Biology of Reproduction, 2014. 90(3):54. DOI: 10.1095/biolreprod.113.115972.
- Batista F.D. The who, how and where of antigen presentation to B cells/F.D. Batista, N.E. Harwood. Nat. Rev. Immunol., 2009. №9. P. 15–27.
- Ertas H.B.A. Isolation of Arcanobacterium (Actinomyces) pyogenes from abscessed cattlekidney and identification by PCR/Ertas H.B., Kilic A., O’zbey G., Muz A. Turk. J. Vet. Anim. Sci., 2005. 29:455–459.
- Goddard P. The perception of welfare of sheep in extensive systems/Goddard P., Waterhouse T., Dwyer C. & Stott A. Small Rum. Res., 2006. 62(3):215–222.
- Gottschalk M., Segura M. The pathogenesis of the meningitis caused by Streptococcus suis: The unresolved questions/Gottschalk M., Segura M. Veterinary microbiology, 2000. 76(3):259–272.
- Hume D.A. Macrophages as APC and the dendritic cell myth/D.A. Hume. Journal of Immunology, 2008. 181(9):5829–5835.
- Han. Effect of the modified live porcine reproductive and respiratory syndrome virus (PRRSV) vaccine on European and North American PRRSV shedding in semen from infected boars/K. Han, H.W. Seo, J.H. Shin, Y. Oh, I. Kang, C. Park, C. Chae. Clinical and Vaccine Immunology, 2011. Vol. 18. №10. P. 1600–1607.
- Lawson P.A. Arcanobacterium pluranimalium spp. nov., isolated from porpoise and deer/Lawson P.A., Falsen E., Foster G., Eriksson E., Weiss N., Collins M.D. Int. J. Syst. Evol. Microbiol., 2001. 51:55–59.
- Liang H. Pyolysin of Trueperella pyogenes induces pyroptosis and IL-1β release in murine macrophages through potassium/NLRP3/Caspase-1/Gasdermin D Pathway/Liang H., Wang B., Wang J., Ma B., Zhang W. Front. Immunol., 2022. 13:832458. DOI: 10.3389/fimmu.2022.832458. PMID: 35371034. PMCID: PMC8965163.
- Machado V. S. Complete genome sequence of Trueperella pyogenes, an important opportunistic pathogen of livestock. Genome announcements/Machado V.S., Bicalho R.S. American Society for Microbiology, 2014. №2(2). DOI:10.1128/genomeA.00400-14. PMC 4007991. PMID 24786956.
- Risseti R. Virulence markers associated with Trueperella pyogenes infections in livestock and companion animals/Risseti R., Zastempovskaya E., Tvaruzhek M., Lassa H., Pantoja J., De Vargas A. et al. Lett. Appl. Microbiol., 2017. 65(2):32–125.
- Rzewuska M. Pathogenicity and virulence of Trueperella pyogenes: A review/Rzewuska M., Kwiecień E., Chrobak-Chmiel D., Kizerwetter-Świda M., Stefańska I., Gieryńska M. Int. J. Mol. Sci., 2019. 20(11):2737. DOI: 10.3390/ijms20112737.
- Yost B.H. Arcanobacterium pyogenes: Molecular pathogenesis of an opportunistic pathogen in animals/Yost B.H., Billington S.J. Antonie Van Leeuwenhoek, 2005. 88:87–102.
- Staats J.J. et al. Streptococcus suis: Past and present. Veterinary Research Communications, 1997. Vol. 21. P. 381–407.
- Wasilk A. Detection of U.S., Lelystad, and European-like porcine reproductive and respiratory syndrome viruses and relative quantitation in boar semen and serum samples by real-time PCR/A. Wasilk, J.D. Callahan, J. Christopher-Hennings, T.A. Gay, Y. Fang, M. Dammen, M.E. Reos, M. Torremorell, D. Polson, M. Mellencamp et al. J. Clin. Microbiol., 2004. Vol. 42. P. 4453– 4461.
- Wilson L.A., Sharp P.M. Enterobacterial repetitive intergenic consensus (ERIC) sequences in Escherichia coli: Evolution and implications for ERIC-PCR. Mol. Biol. Evol., 2006. 23:1156–1168.
- Zhuang C., Zhao J., Zhang S., Shahid M. Escherichia coli infection mediates pyroptosis via activating p53–p21 pathway-regulated apoptosis and cell cycle arrest in bovine mammary epithelial cells. Microb. Pathog., 2023. 184:106338. DOI: 10.1016/j.micpath.2023.106338. Epub. 2023. Sep 6. PMID: 37683833.








