В 2025 году журналу
ИСПОЛНИТСЯ
95 ЛЕТ!
ЧИТАЙТЕ
Материалы к юбилею >>>

РУБРИКИ
 Племенное дело |
 Крупный план |
 Актуально |
 Корма |
 Техническая политика |
 Событие |
 Ветеринария |
 Эксклюзивное интервью |
 Статистика |
 Выставки |
Творчество
наших читателей
ЧИТАЙТЕ
Автор С.И. КАЛИНИЧЕНКО
ГИМН СВИНЬЕ >>>
СТАТЬИ ИЗ НОМЕРА
DOI: 10.37925/0039-713X-2024-4-39-42
УДК 636.4.087.7/.8+636.4.084.1
ВЛИЯНИЕ ЖИВЫХ ДРОЖЖЕЙ НА ОРГАНИЗМ ПОРОСЯТ В ПЕРИОД ДОРАЩИВАНИЯ
Е.Н. КОЛОДИНА, кандидат биолог. наук, ФГБНУ ФИЦ ВИЖ имени Л.К. Эрнста
Изучено влияние живых дрожжей в рационе помесных боровков (F2:(КБхЛ)хД) в период доращивания на микробиоценоз желудочно-кишечного тракта и неспецифический иммунитет.
Было установлено, что введение живых дрожжей в корм свиньям в период доращивания позволило улучшить микробиоценоз ЖКТ. Проведенная оценка основных показателей неспецифического иммунитета выявила достоверно максимальные значения бактерицидной и лизоцимной активности во второй опытной группе – 46,93% и 42,81% соответственно.
Ключевые слова: микроорганизмы, дрожжи, пробиотики, микробиоценоз, естественная резистентность.
The effect of live yeast on the body of piglets during the rearing period
E.N. KOLODINA, candidate of biological sciences, L.K. Ernst Federal Research Center for Animal Husbandry
The effect of live yeast in the diet of crossbred hogs (F2:(LWхL)хD) during the growing period on the microbiocenosis of the gastrointestinal tract and nonspecific immunity was studied. It was found that the introduction of live yeast into pig feed during the rearing period improved the microbiocenosis of the gastrointestinal tract.
The assessment of the main indicators of nonspecific immunity revealed significantly maximum values of bactericidal and lysozyme activity in the second experimental group of 46.93% and 42.81%, respectively.
Key words: microorganisms, yeast, probiotics, microbiocenosis, natural resistance.
Введение
Свиноводство является наиболее скороспелой и высокотехнологичной отраслью. Наряду с надежной кормовой базой повышение продуктивности требует внедрения новых технологических приемов работы с молодняком, в том числе применения экологически чистых, биологически активных веществ, стимулирующих и улучшающих пищеварение, усвояемость корма, процессы роста и развития.
Среди вопросов частной зоотехнии сегодня особое значение имеют способы оптимизации и улучшения технологий выращивания животных, основанные на регуляции физиологии пищеварения. В мировой практике на разных технологических этапах выращивания сельскохозяйственных животных и птицы широко применяют биологически активные препараты.
Большое разнообразие штаммов бактерий и дрожжей используется в качестве пробиотиков для людей и животных. Пробиотики описываются живыми микроорганизмами, которые при введении в достаточных количествах приносят пользу здоровью животных и в некоторых случаях рассматриваются как потенциальная альтернатива антибиотикам в ветеринарии [4]. Все больше внимания уделяется дрожжевым культурам и дрожжевым продуктам в качестве кормовых добавок в питании людей и животных.
В ряде исследований сообщалось, что пищевые добавки с живыми дрожжами, дрожжевыми культурами или продуктами клеточной стенки дрожжей улучшают показатели роста у поросят-отъемышей [7, 19]. Форма, в которой вводятся пробиотические дрожжи, является важным фактором. Например, в результате кормления свиней жидкими ферментированными дрожжами в виде пищевой добавки повышалась продуктивность животных по сравнению с кормлением дрожжами в сухом виде. Жидкие ферментированные формы дрожжей также помогали поддерживать целостность кишечника в период после отъема, тем самым уменьшая симптомы диареи после отъема у поросят [12].
Известно, что семейство Rhodotorula способно продуцировать родоторулевую кислоту, пигменты желтого цвета – Р-каротин, торулен, торулародин, витамины группы В, а также большое количество липидов, что в настоящее время используется в биотехнологии как источник биологически активных веществ [1, 2, 6, 23]. Область применения штамма – производство белка и каратиноидов.
Пробиотические дрожжевые клетки и их метаболиты проявляют полезные антиоксидантные свойства. Образующиеся свободные радикалы нейтрализуются химическими соединениями, называемыми антиоксидантами, но окислительный стресс возникает при дефиците эндогенных антиоксидантов. Пробиотики модифицируют защиту организма хозяина от окислительного стресса посредством образования антимикробных метаболитов, хелатирования ионов металлов и антиоксидантной способности пробиотиков, содействующих снижению микробиоты кишечника [20].
Бактериальная флора желудочно-кишечного тракта оказывает локальное и системное воздействие не только на органы пищеварения, но и на весь организм в целом. В многочисленных исследованиях продемонстрирована патогенетическая связь состояния кишечного микробиоценоза с заболеваниями ЖКТ и болезнями сердечно-сосудистой системы – атеросклероз, артериальная гипертензия, мочевыделительной системы – мочекаменная болезнь, пиелонефрит и другие [11, 16].
Именно микроорганизмы играют решающую роль в поддержании здоровой среды кишечника, дополнительно влияя на использование питательных веществ, физиологическую и иммунную функцию кишечника свиней [8, 14].
На долю иммунной системы ЖКТ приходится примерно 70% от общей популяции иммунных клеток. Кишечник активируется в ответ на стресс, вырабатывается разнообразный набор специализированных иммунных клеток и сигнальных молекул, иногда в ущерб эффективности пищеварения [18].
Продукты микробиологической ферментации углеводов, которые не перевариваются эндогенными ферментами (DF), короткоцепочечные жирные кислоты (SCFAs) являются основным источником энергии для клеток кишечника, поддерживают его здоровье и иммунную функцию [13].
Иммуноглобулины слизистой оболочки, IgA, стимулируются микробной ферментацией и ограничивают проникновение патогенов через эпителиальные клетки кишечника [10].
Таким образом, исследования взаимодействия сложной микробиоты, обитающей в желудочно-кишечном тракте свиней, а также взаимодействия между бактериями и хозяином оказываются ценными для повышения эффективности производства свинины. Поэтому поиск новых дрожжей для использования в качестве пробиотиков является актуальной задачей на сегодняшний день.
Целью работы было изучение влияния культуры живых дрожжей при включении в рацион свиней в период доращивания на состав микробиоценоза желудочно-кишечного тракта и показатели естественной резистентности. Используемые в исследовании дрожжи были выделены в процессе предыдущей научно-исследовательской работы из желудочно-кишечного тракта сельскохозяйственных животных в лаборатории микробиологии ФГБНУ ФИЦ ВИЖ имени Л.К. Эрнста.
Материалы и методы
В условиях физиологического двора ФГБНУ ФИЦ ВИЖ имени Л.К. Эрнста был проведен научно-хозяйственный опыт. Объектом исследований in vivo служили 24 головы помесных боровков (F2:(КБхЛ)хД). Животные были сформированы по принципу пар-аналогов и разделены на две группы со средней живой массой 18,76–18,78 кг (таблица).
Контрольная группа поросят на доращивании получала основной рацион без дополнительных кормовых добавок пробиотического действия.
Таблица. Схема проведения эксперимента
|
Группа |
Голов в группе |
Характеристика кормления |
|
Научно-хозяйственный опыт на поросятах (продолжительность – 30 дней) |
||
|
Контрольная |
12 |
Комбикорм стандартный СК-4 (КК) |
|
Опытная |
12 |
КК с дополнительным включением 2 мл живых дрожжей (106 КОЕ/мл) на 1 кг рациона |
Основной корм – комбикорм СК-4 (КК) по показателям энергетической и питательной ценности соответствовал требованиям для данного возрастного и весового параметра животных [3, 5].
Работа проводилась in vitro в лаборатории микробиологии ФГБНУ ФИЦ ВИЖ имени Л.К. Эрнста. Материалом для исследования служило содержимое толстого отдела кишечника свиней, сыворотка крови и цельная кровь. Забор образцов производился в соответствии с ГОСТом 25383-82. Образцы отбирали до постановки животных на опыт и в конце опытного периода.
Микробиологический анализ образцов содержимого желудочно-кишечного тракта свиней исследовали посредством высева последовательных десятикратных разведений на накопительные и дифференциально-диагностические среды (ФБУН ГНЦ ПМБ») глубинным (1,0 мл) и поверхностным (0,2 мл) методами с последующим подсчетом количества колониеобразуюших единиц (КОЕ/г). Показатели неспецифического иммунитета были определены по модифицированным методикам с использованием микробиологического анализатора Multiskan FC (Thermo Fisher Scientific Inc., Финляндия). Исследование фагоцитарной активности цельной крови проводили по В.С. Гостьеву.
Достоверность полученных результатов определяли с помощью t-критерия Стьюдента. Данные подвергали статистическому анализу с использованием пакетов программ Microsoft Office Excel 2010. Разницу в значениях считали статистически достоверной при P<0,05, P<0,01 и P<0,001.
Результаты и обсуждения
Кишечный тракт является крупнейшим органом иммунной системы животных. И поддержание нормальной барьерной функции кишечника чрезвычайно важно для хорошего здоровья кишечника [9]. В свою очередь, микрофлора кишечника играет ключевую роль в физиологии пищеварения, помогая в процессах поглощения и усвоения питательных веществ, тем самым поддерживая гомеостаз в кишечнике хозяина. Сбалансированный микробный состав считается необходимым для здоровья животного, и его нарушения часто приводят к дисфункциональному кишечнику, что влечет за собой расстройства и аномалии, связанные с кишечником [16].
Влияние живых дрожжей на изменения кишечной микробиоты и ее активности у свиней в период доращивания показано на рисунках 1, 2.
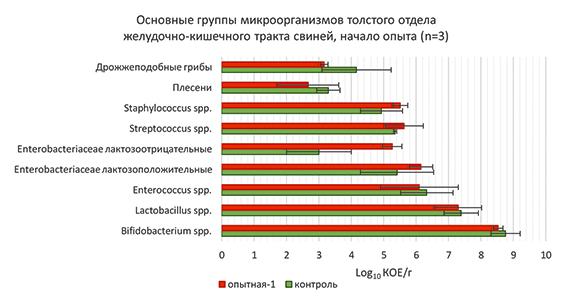
Рис. 1. Микробиоценоз толстого отдела кишечника свиней в начале опытного периода (log10 КОЕ/г)
На начало исследований в образцах кишечника свиней контрольной группы отмечалось более высокое содержание дрожжеподобных грибов и плесеней и более низкое содержание бактерий рода Enterococcus, Lactobacillus и Bifidobacterium по сравнению с опытной группой (рис. 1). Кишечная популяция Enterobacteriaceae свиней весьма индивидуальна. При этом Enterobacteriaceae необязательно прикрепляются к слизистой оболочке в больших количествах для успешной колонизации кишечника. E.coli, E.cloacae, K.pneumoniae и C.freundii могут быть выделены как доминирующие Enterobacteriaceae у свиней [22].
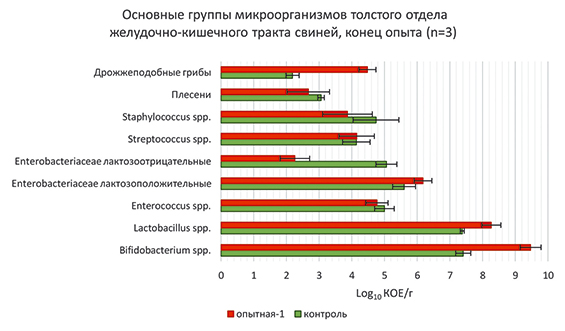
Рис. 2. Микробиоценоз толстого отдела кишечника свиней в конце опытного периода (log10 КОЕ/г)
Лактобациллы представляют собой грамположительные факультативно-анаэробные или микроаэрофильные бактерии, которые повышают эффективность переработки корма у животных. Кроме того, лактобациллы вырабатывают молочную кислоту, которая оказывает ингибирующее действие на E.coli и энтеробактерии [17].
Общее количество бактерий рода Lactobacillus на начало опыта было одинаково в обеих группах, а к концу опытного периода число бактерий рода Lactobacillus увеличилось у животных опытной группы на 0,89 log10 КОЕ/г (Р≤0,001), что привело к лучшей ферментации корма в течение всего периода испытаний.
В ходе исследований было обнаружено, что в начале исследований популяция Bifidobacterium в опытной группе была незначительной – 0,23 log10 КОЕ/г, но ниже, чем у контрольных животных. К концу опытного периода наблюдалось достоверное увеличение Bifidobacterium в опытной группе – 9,47±0,32 log10 КОЕ/г по сравнению с контролем – 7,41±0,23 log10 КОЕ/г (рис. 2).
Количество лактозоотрицательных Enterobacteriaceae, включающих род Proteus, Providencia и Morganella, в конце опытного периода составило 2,26±0,45 log10 КОЕ/г (Р≤0,01) в опытной группе по сравнению с более высоким числом – 5,06±0,32 log10 КОЕ/г в контроле. Среднее значение лактозоположительных Enterobacteriaceae у животных опытной группы было больше на 3,92 log10 КОЕ/г по отношению к лактозоотрицательным и на 0,58 log10 КОЕ/г по отношению к контролю.
Снижение количества гемолитических микроорганизмов наблюдалось в образцах кишечного содержимого животных всех групп. Так, число Streptococcus spp. снизилось на 1,21 и 1,48 log10 КОЕ/г соответственно в контрольной и опытной группе, а также сократилось и количество Staphylococcus spp. на 0,19 и 1,64 log10 КОЕ/г соответственно.
У свиней в микробиоте кишечника преобладают грибковые популяции, представители семейства Saccharomycetaceae и Cryptococcaceae. Образцы культивируемых фекалий демонстрируют увеличение грибковой нагрузки в конце опытного периода, но не отличаются от установленных уровней у взрослых свиней, что свидетельствует о стабильной колонизации желудочно-кишечного тракта в период доращивания. Дрожжи могут связывать поверхности энтеробактерий и тем самым блокировать связывание этих бактерий с эпителием кишечника [21].
Также важную роль в ингибировании Enterobacteriaceae играет низкий pH, изменения которого могут происходить под действием увеличения количества Lactobacillus, дрожжей и продуктов их жизнедеятельности.
Анализ представленных данных свидетельствует о том, что микрофлора кишечника здоровых свиней находится в состоянии динамического равновесия, обеспечивающего нормальную жизнедеятельность.
Таким образом, было установлено, что введение живых дрожжей в корм свиньям в период доращивания позволило улучшить микробиоценоз желудочно-кишечного тракта в сторону преобладания бактерий рода Bifidobacterium и Lactobacillus при снижении гемолитических Streptococcus spp. и Staphylococcus spp.
Эти данные коррелируются с полученными ранее результатами по изучению показателей естественной резистентности и подтверждают мнение о том, что морфология кишечника может быть связана с иммунитетом. Так, Z. Jiang et al. установили, что добавление в основной рацион 3 г на 1 кг живых дрожжей (LY) и 3 г на 1 кг дрожжевых порошков сверхтонкого помола (SFY) (S.cerevisiae, штамм Y200007) улучшали конверсию корма, развитие тонкого кишечника и системный иммунитет у поросят, отлученных в возрасте 14 дней (исходная средняя масса – 4,5 кг) [15].
В наших исследованиях лизоцимная активность сыворотки крови животных опытной группы составила 37,04%, а в контрольной группе – 33,52%. Фагоцитарная активность крови животных опытной группы была больше на 3,0% относительно контроля. При достаточно высоких показателях фагоцитоза достоверных различий между контрольной и опытной группой не установлено (рис. 3).
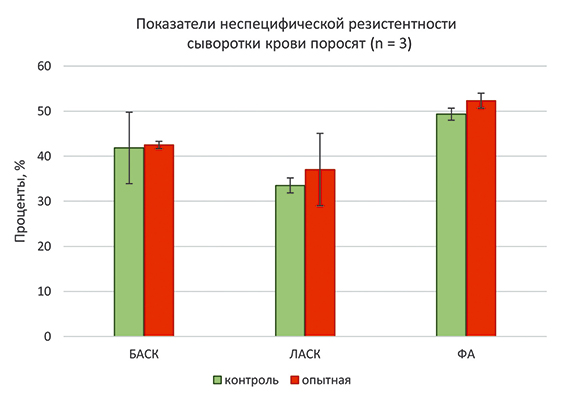
Рис. 3. Показатели неспецифической резистентности сыворотки крови поросят
Заключение
Таким образом, данные указывают на благотворное влияние живых дрожжей на иммунитет и микробиоценоз кишечника интенсивно растущих свиней, что может являться дополнительным инструментом повышения адаптации животных к условиям среды.
Работа выполнена при финансовой поддержке Минобрнауки России, FGGN-2024-0016 (124020200032-4)
Литература
- Иванченко О.Б., Мартынова Е.А. Влияние микотоксина фумонизина В1 на рост и гибель клеток дрожжей Rhodotorula spp. Патогенез, 2012. Т. 10. №2. С. 75–82.
- Криворутченко Ю.Л., Кирсанова М.А., Постникова О.Н., Логадырь Т.А., Чепурина Д.В., Шейко Е.А, Шевкопляс Л.А. Воздействие антифунгальных препаратов на бактерии и дрожжеподобные грибы, выделенные от людей в Крыму. Ученые записки Крымского федерального университета имени В.И. Вернадского. Биология. Химия, 2019. Т. 5(71). №2. С. 92–103.
- Нормы и рационы кормления сельскохозяйственных животных: Справочное пособие/Под ред. А.П. Калашникова, В.И. Фисинина, В.В. Щеглова, Н.И. Клейменова. 3-е изд. перераб. и доп. М., 2003. 456 с.
- Оценка полезных и питательных свойств пробиотиков в пищевых продуктах, включая сухое молоко с живыми молочнокислыми бактериями. Отчет о консультациях экспертов ФАО/ВОЗ, 2001.
- Чернышев Н.И. Компоненты комбикормов/Чернышев Н.И., Панин И.Г. 3-е изд. Воронеж: Воронежская областная типография, 2012. 152 с.
- Biswas S., Yokoyama K., Nishimura K., Miyaji M. Molecular phylogenetics of the genus Rhodotorula and related basidiomycetous yeast inferred from the mitochondrial cytochrome b gene. Int. J. Syst. Evol. Microbiol., 2001. Vol. 51. P. 1191–1199. DOI: 10.1099/00207713-51-3-1191.
- Bontempo V., Giancamillo A.D., Savoini G. Live yeast dietary supplementation acts upon intestinal morpho-functional aspects and growth in weanling piglets. Animal Feed Science and Technology, 2006. 129(3):224–236. DOI: 10.1016/j.anifeedsci.2005.12.015.
- Cantarel B.L., Lombard V., Henrissat B. Complex carbohydrate utilization by the healthy human microbiome. PLoS One, 2012. 7(6):e28742. DOI: 10.1371/journal.pone.0028742.
- Chassaing B., Kumar M., Baker M.T., Singh V. and Vijay-Kuma M. Mammalian gut immunity. Biomed. J., 2014. №37. Р. 246–258. DOI: 10.4103/2319-4170.130922.
- Che, Chen L.H., Yu B., He J., Zheng P., Mao X., Yu J., Huang Z., Chen D. Long-term intake of pea fiber affects colonic barrier function, bacterial and transcriptional profile in pig model. Nutr., 2014. Cancer66. P. 388–399. DOI: 10.1080/01635581.2014.884229.
- Eckburg P.B., Bik E.M., Bernstein C.N., Purdom E., Dethlefsen L. et al. Diversity of the human intestinal microbial flora. Science, 2005. 308(5728): 1635–1638. DOI: 10.1126/science.1110591.
- González-Ortiz G., Callegari M.A., Wilcock P., Melo-Durán D., Bedford M.R., Oliveira H.R., da Silva M.A., Pierozan C.R. & da Silva C.A. Dietary xylanase and live yeast supplementation influence intestinal bacterial populations and growth performance of piglets fed a sorghum-based diet. Animal Nutrition, 2020. 6(4):457–466. DOI: 10.1016/j.aninu.2020.05.005.
- Jha R., Berrocoso J.D. Dietary fiber utilization and its effects on physiological functions and gut health of swine. Animal, 2015. 9(9):52–1441. DOI: 10.1017/S1751731115000919.
- Jha R., Fouhse J.M., Tiwari U.P., Li L., Willing B.P. Dietary fiber and intestinal health of monogastric animals. Front. Vet. Sci., 2019. 6:48. DOI: 10.3389/fvets.2019.00048.
- Jiang Z. Effects of different forms of yeast Saccharomyces cerevisiae on growth performance, intestinal development, and systemic immunity in early-weaned piglets/Jiang Z., Wei S., Wang Z., Zhu C., Hu S., Zheng C., Chen Z., Hu Y., Wang L., Ma X. & Yang X. Journal of Animal Science and Biotechnology, 2015. 6(1):47. DOI: 10.1186/s40104-015-0046-8. URL: https://jasbsci.biomedcentral.com/articles/10.1186/s40104-015-0046-8.
- Les Dethlefsen M.M.F.N., Relman D.A. An ecological and evolutionary perspective on human microbe mutualism and disease. Nature, 2007. 449:811–818. DOI: 10.1038/nature06245.
- Li D., Ni K., Pang H., Wang Y., Cai Y., Jin Q. Identification and antimicrobial activity detection of lactic acid bacteria isolated from corn stover silage. Asian-Australas J. Anim. Sci., 2015. 28:620+. DOI: 10.5713/ajas.14.0439.
- Liao S.F., Nyachoti M. Using probiotics to improve swine gut health and nutrient utilization. Anim. Nutr., 2017. 3(4):331–343. DOI: 10.1016/j.aninu.2017.06.007.
- Liu X., Li T. & Ho K.I. Effects of yeast culture (Saccharomyces cerevisiae) supplementation on growth performance, fecal score, and nutrient digestibility of weaning pigs. Korean Journal of Agricultural Science, 2018. 45:677–685. DOI: 10.2141/ jpsa.0190144.
- M.H. Floch, Y. Ringel and W.A. Walker. The microbiota in gastrointestinal pathophysiology: Implications for human health, prebiotics, probiotics and dysbiosis. 2017. P. 409–419.
- Mul A.J., Perry F.G. The role of fructooligosaccharides in animal nutrition/Garnsworthy P.C., Cole D.J.A. (eds)//Recent Advances in Animal Nutrition. Nottingham: Nottingham University Press. 1994. P. 57–79.
- Schierack P., Walk N., Reiter K., Weyrauch K.D., Wieler L.H. Composition of intestinal Enterobacteriaceae populations of healthy domestic pigs. Microbiology, 2007. Vol. 153. Р. 3830–3837. doi.org/10.1099/mic.0.2007/010173-0.
- Yen H.W., Zhang Z. Effects of dissolved oxygen level on cell growth and total lipid accumulation in the cultivation of Rhodotorula glutinis. J. Biosci. Bioeng., 2011. Vol. 112. №1. P. 71–74. DOI: 10.1016 /j.jbiosc.2011.03.013.








