В 2025 году журналу
ИСПОЛНИТСЯ
95 ЛЕТ!
ЧИТАЙТЕ
Материалы к юбилею >>>

РУБРИКИ
 Племенное дело |
 Крупный план |
 Актуально |
 Корма |
 Техническая политика |
 Событие |
 Ветеринария |
 Эксклюзивное интервью |
 Статистика |
 Выставки |
Творчество
наших читателей
ЧИТАЙТЕ
Автор С.И. КАЛИНИЧЕНКО
ГИМН СВИНЬЕ >>>
СТАТЬИ ИЗ НОМЕРА
УДК 619:616.98:578.831.31:636.4
ИММУНОЦИТОХИМИЧЕСКИЙ МЕТОД ДЛЯ ДИАГНОСТИКИ ЦИРКОВИРУСНОЙ ИНФЕКЦИИ СВИНЕЙ
И.Н. МАТВЕЕВА, доктор биолог. наук, профессор, зам. директора, Е.В. МАРКОВА, кандидат с.-х. наук, ст. научный сотрудник отдела молекулярной биологии и вирусологии, О.А. БОГОМОЛОВА, кандидат биолог. наук, ст. научный сотрудник отдела иммунологии, Ю.Н. ФЕДОРОВ, член-корреспондент РАН, гл. научный сотрудник, Л.С. ЛЮЛЬКОВА, доктор биолог. наук, вед. научный сотрудник отдела обеспечения качества лекарственных средств, ФГБНУ ВНИТИБП
В статье изложены методические решения оптимизации иммуноцитохимического анализа для выявления антигена цирковируса свиней 2-го типа в культуре клеток РК-15. Установлено влияние фиксации, характера блокирования неспецифического связывания антител, температурного режима и времени инкубации на результаты иммуноцитохимической реакции. На основании полученных данных предложен эффективный метод обнаружения антигена цирковируса свиней 2-го типа в культуре клеток.
Ключевые слова: иммуноцитохимия, репродукция, цирковирус свиней 2-го типа, культура клеток.
Immunocytochemical method for diagnostics of Porcine Circovirus infection
I.N. MATVEEVA, doctor of biological sciences, deputy director, E.V. MARKOVA, candidate of agricultural sciences, senior researcher of department of molecular biology and virology, O.A. BOGOMOLOVA, candidate of biological sciences, senior researcher of department of immunology, Yu.N. FEDOROV, corresponding member of RAS, chief researcher, L.S. LYULKOVA, doctor of biological sciences, leading researcher of drug quality assurance department, FSBI VNITIBP
The article presents methodological solutions for optimizing immunocytochemical analysis for detecting pig circovirus type 2 antigen in PK-15 cell culture. The effect of fixation, blocking of non-specific antibody binding, temperature regime and incubation time on the results of immunocytochemical reaction was established. Based on the results obtained, an effective method for detecting pig circovirus type 2 antigen in cell culture is proposed.
Key words: immunocytochemistry, reproduction, Porcine Circovirus type 2, cell culture.
DOI: 10.37925/0039-713X-2020-4-51-53
В промышленном свиноводстве респираторные болезни имеют сложную этиологическую структуру и наносят значительный экономический ущерб. В качестве одного из основных этиологических агентов выступает цирковирус свиней 2-го типа [4, 11, 13]. Возбудитель характеризуется тем, что первоначально локализуется и размножается в активированных иммунокомпетентных клетках, вызывая апоптоз, вирусиндуцированный лизис и деструкцию лимфоидных структур [10, 14]. В результате разрушения этих клеток развивается иммунодефицитное состояние организма, на этом фоне возникают вторичные инфекционные заболевания бактериальной и вирусной природы (микоплазмоз, стрептококкоз, пастереллез, стафилококкоз, гемофилез, репродуктивно-респираторный синдром, грипп свиней, парвовирусная инфекция и др.). В клинической форме цирковирусная инфекция проявляется у поросят после их отъема от свиноматок через две-три недели и в период откорма. Распространению цирковируса свиней 2-го типа способствует высокая контагиозность и устойчивость возбудителя к дезинфектантам. У больных животных наблюдают отказ от корма, одышку, лихорадку, истощение, отставание в росте, увеличение паховых лимфоузлов, бледность или желтушность кожи, развивается респираторный и дерматонефропатический синдром [1, 2, 5, 6, 9]. На фото 1 представлена клиническая форма проявления болезни у свиней на откорме.

Фото 1. Клиническое проявление: изменения кожного покрова у животных с дерматонефропатическим синдромом, ассоциированным с цирковирусом свиней 2-го типа
В мировой практике для диагностики цирковирусной инфекции свиней в лабораторных условиях применяют следующие методы: метод флуоресцирующих антител (FAVN), иммунопероксидазный тест в фиксированной культуре клеток (IPMA), иммуноферментный анализ (ELISA) и полимеразную цепную реакцию (PCR). Наиболее специфичным для визуального выявления антигена при контроле вирусного сырья, оценке инфекционной активности цирковируса 2-го типа является иммуноцитохимический (иммунопероксидазный) тест в культуре клеток [3, 7, 8, 12].
Цель исследования заключалась в разработке иммуноцитохимического теста в фиксированной культуре клеток для диагностики цирковирусной инфекции свиней.
Материалы и методы
Иммунопероксидазный тест для диагностики цирковирусной инфекции свиней включает в себя этапы: посев клеток чувствительной культуры на 96-луночные пластиковые микропланшеты с плоским дном; разведение опытного вируссодержащего материала методом десятикратных разведений в 96-ячеистых пластиковых микропланшетах с круглым дном с дальнейшим его перенесением в ячейки микропланшета с монослоем культуры клеток. На следующем этапе проводится выдержка в течение пяти-семи суток в условиях СО2-инкубатора, удаление из ячеек микропланшета культуральной среды с отмыванием монослоя клеток и добавление фиксирующего буфера во все ячейки микропланшета. Далее в ячейки микропланшета поэтапно вносится рабочее разведение специфической сыворотки крови, конъюгата, раствора субстрата. Учет реакции осуществляется с помощью инвертированного светового микроскопа, в котором инфицированные клетки имеют вид одиночных клеток или скоплений клеток (бляшек) с окрашенной в красный цвет цитоплазмой и светлым ядром.
Исследования проводили на перевиваемой линии клеток РК-15 (почка поросенка). В качестве питательной среды использовали DMEM и Игла с содержанием 5%-ной фетальной сыворотки крупного рогатого скота производства ФБУН «Государственный научный центр вирусологии и биотехнологии «Вектор» Роспотребнадзора. Биологическую активность РСV2 определяли путем титрования, титр вируса рассчитывали по методу Рида и Менча. Контроль вирусного генома РСV2 методом ПЦР осуществлялся во Всероссийском научно-исследовательском институте защиты животных (ФГБУ «ВНИИЗЖ») [7]. Результаты иммуноцитохимического окрашивания антигена вируса в фиксированной культуре клеток учитывали с помощью инвертированного микроскопа Olympus с выводом изображения цифровой цветной камерой CMOS 5 Мп, адаптером 0,35 С-Mount на компьютер с портом USB 3.0.
Результаты и обсуждение
В культуре клеток РК-15 цирковирус свиней 2-го типа накапливается в достаточно высоких титрах, не вызывая цитопатического эффекта. При работе с нецитопатогенными вирусами, которые не проявляют своего действия на культуре клеток, особое значение приобретает подбор систем выявления вируса и подтверждения его подлинности. Метод иммуноцитохимии белков по известным протоколам для индикации вирусных антигенов PCV2 в культуре клеток оказался неэффективным, так как в процессе обнаружения антигена цирковируса свиней 2-го типа происходило высокое фоновое окрашивание, которое не позволяло идентифицировать клетки, инфицированные вирусом, в сравнении с контролем.
Для выявления антигена цирковируса 2-го типа при иммуноцитохимическом анализе требуется подбор составляющих компонентов. Наличие эндогенных пероксидов вызывает существенное фоновое окрашивание, что затрудняет детекцию вируса. При этом при иммуноцитохимическом окрашивании важное значение имеет устойчивость антигена, учитывая особенности вирусного белка противостоять влиянию наиболее широко применяемых фиксаторов. На активность вирусного белка оказывает воздействие химическая обработка, предшествующая инкубации со специфическими антителами.
Решение проблемы выявления у свиней цирковируса 2-го типа достигнуто за счет применения иммуноцитохимического варианта иммуноферментного анализа с использованием стандартной перевиваемой культуры клеток РК-15, инфицированной вирусом PCV2. Фиксацию и пермеабилизацию инфицированной культуры клеток осуществляли одновременно в течение 30‒40 минут в 0,01‒0,02 М- фосфатном буфере рН 7,2‒7,4, содержащем 1‒4%-ный параформальдегид (параформ) и 0,2‒0,4%-ный нонилфенилполиэтиленгликоль «Нонидент NP40», при температуре +22…+24°С. На следующем этапе проводили последовательную обработку в течение 10‒20 минут 0,01‒0,02 М-фосфатно-солевым буфером рН 7,2‒7,4, содержащим 0,3‒0,4 М-глицин и 1‒2%-ный казеин, и 0,3‒0,6%-ной перекисью водорода. Затем наносили специфические поликлональные антитела, а антиген цирковируса свиней 2-го типа обнаруживали в световом микроскопе по наличию темно-красного окрашивания цитоплазмы клеток.
В качестве фиксатора использовали 10%-ный раствор забуференного формалина, но такая фиксация не обеспечивала адекватной сохранности цитологических структур. Однако она широко используется, в первую очередь – для патоморфологических исследований в медицине. Преимущество такой фиксации – быстрота и простота приготовления фиксатора, его дешевизна. Параформальдегид ‒ удобный источник для получения формальдегида. В этих исследованиях использован универсальный фиксатор, который готовили из параформальдегида на солевых растворах, применяемых при культивировании клеток. Очевидно, что эти растворы по своему составу наиболее адекватны внутренней среде живых клеток. В работе использован 1‒4%-ный раствор параформальдегида. Как показали исследования, для проведения иммуноцитохимической реакции следует применять 1‒4%-ный забуференный параформальдегид, при этом необходимо строго соблюдать время фиксации. Непродолжительная фиксация приводит к диффузии, вымыванию антигена, а длительная обуславливает маскировку антигена, образование большого числа альдегидных связей, препятствующих проявлению реакции антиген ‒ антитело. Для получения морфологической картины и оптимальной возможности выявления антигена цирковируса свиней 2-го типа фиксация культуры клеток должна осуществляться в 1‒4%-ном забуференном параформальдегиде в течение 30‒40 минут. Пермеабилизацию для обнаружения антигена производили с помощью «Нонидента (NP40)», который оказался более стабильным, чем «Тритон Х-100», который накапливает пероксиды при хранении. Пермеабилизация нужна для достижения антителами внутриклеточной части клеток, так как эпитопы находятся в цитоплазматической области (внутриклеточные и трансмембранные белки). С этой целью проводится обработка 0,3‒0,4 М- глицином в течение 10‒20 минут для повышения проницаемости клеточных мембран и устранения «сшивок» между белками, образовавшихся в результате фиксации. Глицин в указанной концентрации связывает свободные альдегидные группы, способствует взаимодействию антигена с антителами, препятствует неспецифическому связыванию первичных и вторичных антител, тем самым снижая фоновое окрашивание. Предложенный комплекс методических приемов, выполняемых в процессе иммуноцитохимического окрашивания, дает объективные результаты и позволяет провести их интерпретацию.
Наличие антигена цирковируса свиней 2-го типа в культуре клеток при иммуноцитохимическом окрашивании оценивали по темно-коричневой (3,3’-диаминобензидин) или красной окраске (3-амино-9-этилкарбазол) цитоплазмы зараженных клеток и отсутствию окрашивания цитоплазмы в неинфицированных клетках (фото 2).
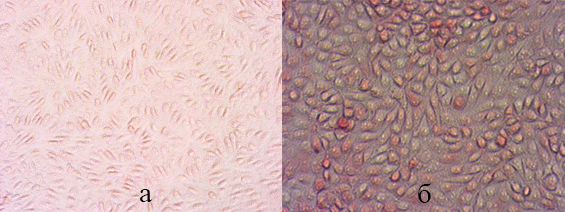
Фото 2. Выявление антигена цирковируса в фиксированной культуре клеток методом иммуноцитохимического окрашивания: а) культура клеток, не инфицированная вирусом; б) культура клеток, инфицированная вирусом
Заключение
В результате исследований разработан иммуноцитохимический метод выявления антигена цирковируса свиней 2-го типа в культуре клеток, фиксированной 1‒4%-ным раствором параформальдегида. С помощью особых методических подходов был подобран протокол, позволяющий обеспечить минимальный уровень фонового окрашивания при высоком уровне специфического связывания антител. Иммуноцитохимический тест для вирусологической диагностики цирковирусной инфекции свиней в культуре клеток РК-15 может быть использован в научно-исследовательских институтах и ветеринарных лабораториях для выявления антигена цирковируса свиней 2-го типа.
Литература
- Дрю Т. Синдром мультисистемного послеотъемного истощения, дерматит и синдром нефропатии/Т. Дрю//Материалы XIV Международного ветеринарного конгресса. Москва, 2006. С. 21‒24.
- Самуйленко А.Я., Фролов Ю.Д., Евглевский А.А., Матвеева И.Н. Иммунопрофилактика и терапия инфекционных болезней: монография. Курский НИИ АПП, 2015. 409 с.
- Маркова Е.В., Матвеева И.Н., Иванов И.В. и др. Изучение инфекционной активности нецитопатогенного цирковируса свиней 2-го типа в реакции непрямой иммунофлуоресценции. Научный альманах, 2018. 7-1(45). С. 201‒204.
- Орлянкин Б.Г., Алипер Т.И., Непоклонов Е.А. Цирковирусная инфекция свиней. Ветеринария, 2002. №11. С. 48‒52.
- Орлянкин Б.Г., Мишин А.М., Алипер Т.И. Цирковирусные болезни свиней//Актуальные инфекционные болезни свиней: руководство для студентов, научных и практических специалистов. Под ред. Алипера Т.И. М.: ЗооВетКнига, 2019. С. 211‒217.
- Ситюк М.П. Цирковірусні інфекції/М.П. Ситюк, В.А. Байдалюк, С.А. Ничик, А.В. Розумнюк, I.В. Галка, В.М. Шапошнік, І.Л. Фурда. Київ: Аграрна наука, 2017. 128 с.
- Тимина A.M., Щербаков А.В., Ковалишин В.Ф. Выявление и дифференциация цирковирусов свиней методом мультиплексной ПЦР. Труды Федерального центра охраны здоровья животных, 2006. №4. С. 91–101.
- Brunborg I.M. Quantitation of Porcine Circovirus type 2 isolated from serum (plasma) and tissue samples of healthy pigs and pigs with postweaning multisystemic wasting syndrome using a TaqMan-based real-time PCR/Brunborg I.M., Moldal T., Jonassen C.M. J. Virol. Meth., 2004. №122(2). Р. 171‒178.
- Chae C. A review of Porcine Circovirus 2-associated syndromes and diseases/Chae C. A. Vet. J., 2005. №169(3). Р. 326‒336.
- Darwich L. Immunology of Porcine Circovirus type 2 (PCV2)/Darwich L., Mateu E. Virus Research, 2012. №164. Р. 61‒67.
- Harding J.C. The clinical expression and emergence of Porcine Circovirus 2/Harding J.C. Vet. Microbiology, 2004. №98(2). Р. 131‒135.
- Segales J. Porcine Circovirus type 2 (PCV2) infections: Clinical signs, pathology and laboratory diagnosis/Segales J. Virus Research, 2012. №164. Р. 10‒19.
- Tischer I. Studies on epidemiology and pathogenicity of Porcine Circovirus./Tischer I., Mields W., Wolff D. et al. Arch. Virol., 1986. №91(3‒4). Р. 271‒276.
- Vincent I.E., Carrasco C.P., Guzylack-Piriou L. et al. Subset-dependent modulation of dendritic cell activity by circovirus type 2/Vincent I.E., Carrasco C.P., Guzylack-Piriou L. et al. Immunology, 2005. №115(3). Р. 388‒398.








